INTRODUCTION
Peripheral facial palsy is a cranial nerve neuropathy that significantly reduces the quality of life of affected patients. An ophthalmologist might be the first healthcare provider that a patient with acute facial palsy consults. There are multiple causes of facial palsy. One of the most common is Bell’s palsy (idiopathic), which accounts for 70% of cases [1]. Other causes include infection, trauma, neoplastic process, autoimmune diseases, and iatrogenic factors [2]. Prognosis has been found to be associated with the cause of facial palsy. In patients with traumatic or iatrogenic palsy, the prognosis is typically less favorable, while in cases of Bell’s palsy, complete and spontaneous recovery of nerve function commonly occurs within 3 to 4 months [1]. The therapeutic approach is determined by the expected likelihood of spontaneous improvement. Furthermore, the patient’s age, overall health status, and capacity to adhere to therapeutic recommendations and attend follow-up appointments are considered. In addition to conservative treatment, surgical options are available, including ophthalmological interventions aimed at providing temporary eye protection or permanent correction of eyelid position as well as procedures performed by specialists in other disciplines, such as cross-facial nerve grafting or muscle transposition. Procedures that can be reversed when the orbicularis oculi muscle regains function include temporary tarsorrhaphy and eyelid implant placement. In patients with persistent and irreversible palsy, permanent lateral and medial tarsorrhaphy and eyelid implant surgery are performed. At present, tarsorrhaphy is experiencing a decline in popularity due to the limited satisfaction with the aesthetic outcomes among both patients and surgeons.
In many cases, the treatment of choice involves the placement of eyelid implant. It is a fast, reversible, and effective treatment modality for paralytic lagophthalmos. Nevertheless, it carries a risk of complications. One of the most common is implant migration, occurring in 0-15% of primary gold weight implantation procedures [3-6].
The aim of this study is to present two cases of patients with eyelid implant migration and to discuss potential complications associated with eyelid implant surgery, with a specific focus on implant migration.
CASE REPORTS
Case 1
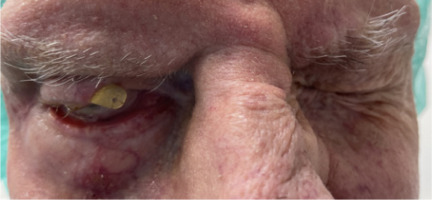
An 88-year-old patient underwent gold weight implant surgery in the upper eyelid of the right eye at another medical center three years previously due to facial palsy following the excision of squamous cell carcinoma involving the scalp together with a fragment of the skull bone in the right parietal region. He reported to the Warsaw Eye Hospital because of implant extrusion that had occurred a week prior. On examination, the patient presented with no pain, fever, or signs of inflammation in the eyelids. Physical assessment revealed a gold weight implant piercing through the skin and visible up to half of its longitudinal dimension. Skin thinning was observed around the implant. The patient exhibited lagophthalmos of the right eye, with preserved Bell’s phenomenon (Figure 1). Evaluation of ocular motility and visual acuity proved difficult because the patient was uncooperative. Intraocular pressure was 12 mmHg in the right eye and 13 mmHg in the left eye. Anterior segment evaluation revealed no significant abnormalities. The patient’s right eye was quiet, and the cornea appeared smooth, glossy, and transparent. The anterior chamber was clear, while the lens revealed early-stage opacities. Neither the patient’s history nor the available medical records provided any information regarding the weight of the implant, the method of production, or the surgical technique.
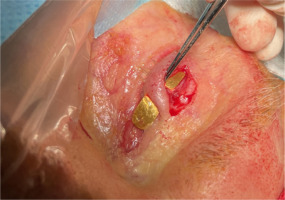
The implant removal procedure was performed under local anesthesia, from a percutaneous approach in the palpebral sulcus. Intraoperatively, it was noted that the weight was unilaterally secured to the tarsus with non-absorbable sutures (Figure 2). The implant was not covered by fibrous tissue. The implant bed was rinsed with gentamicin solution and the tissues were closed in layers. An oral antibiotic was prescribed.
The patient did not attend any further follow-up appointments because immediately after the procedure he had a scheduled hospital stay for the treatment of metastatic cancer.
Case 2
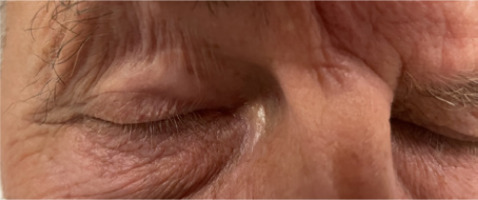
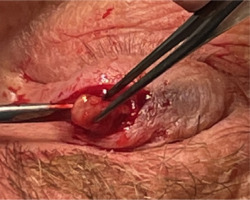
A 61-year-old patient reported to the Ophthalmology Outpatient Clinic at the National Medical Institute of the Ministry of the Interior and Administration in Warsaw because of migration of the right eyelid implant, which had been felt under the skin for several months. The implant was placed at another medical center, in 2018, to treat lagophthalmos caused by surgery to remove a tumor in the right cerebellopontine angle. Later in 2018, the patient underwent anastomosis of the right hypoglossal nerve with the peripheral part of the right facial nerve. The procedure brought a very good functional effect. On examination, the patient’s eyelids were positioned at an equal height, with full eyelid closure. Ocular motility was preserved in all directions. The pupils were round and symmetrical, with normal direct and consensual light reflex. The implant was palpable under the skin, moving freely without causing any pain (Figure 3). The skin on the upper eyelid was unchanged. The patient had full best corrected visual acuity in both eyes measured by the Snellen chart. Intraocular pressure was 18 mmHg bilaterally. Anterior segment evaluation found no abnormalities. The patient underwent a surgical procedure to remove the implant through anterior incision in the palpebral sulcus. Intraoperatively, the implant was found to be encapsulated, and non-absorbable sutures were identified on the surface of the weight (Figure 4). The implant was entirely disconnected from the tarsal surface. Following the procedure, the orbicularis oculi muscle was fixed with single Vicryl 6/0 sutures, and the skin was closed with a continuous intradermal Prolene 5/0 suture. After the procedure, the patient had full eyelid closure and symmetrical positioning of the upper eyelids. Consequently, it was decided not to perform reimplantation.
DISCUSSION
Eyelid implant surgery is the procedure of choice in many cases of paralytic lagophthalmos. The procedures have been performed since 1958. At present, eyelid implants are an element of routine management of paralytic lagophthalmos due to their high efficacy and a strong safety profile [7]. They typically have no adverse effect on the patient’s visual acuity or visual field, while potentially reducing the need to use lubricating eye drops and other measures to relieve dry eyes. They may be reversible if the palsy resolves. In the early stages of facial palsy, they can be affixed to the upper eyelid, enhancing closure through a completely non-invasive method. They can be implanted inside the eyelid at any point during the course of the condition to enhance the overall esthetic appearance. Advantages of eyelid implants include:
An implant of properly selected weight is placed beneath the orbicularis oculi muscle and fixed to the tarsus with non-absorbable sutures. Supplementary procedures can be performed concurrently to correct the position of the eyelids, such as horizontal shortening of the lower eyelid, direct eyebrow lifting, or blepharoplasty. Currently, the available eyelid implant options include gold and platinum weights [10]. Both types are characterized by high biocompatibility and minimal potential to induce inflammation [11]. Platinum implants offer an advantage because of their reduced size and thinner profile, which is due to platinum’s higher density compared to gold [12]. Their disadvantage lies in the high cost. Gold weights are more allergenic, with 7% of patients developing allergy reactions to gold weight eyelid implants [13]. They are primarily categorized as type IV hypersensitivity reactions [14]. The most frequently used implants are plate-shaped, with rounded edges. Chain implants are another option. They are better adapted to the curvature of the eyelid, resulting in reduced astigmatism and improved esthetic outcomes [13]. In cases of under- or over-correction, it is possible to add or remove one chain link without the need to explant the entire weight [15]. Eyelid implant surgery, despite its many advantages, can be associated with complications. Depending on the author, the complication rate varies from 0 to 61% [16, 17]. The paper presents two cases of implant migration, which is among the more common complications associated with this procedure. Other complications associated with eyelid implant surgery include residual lagophthalmos, ptosis, entropion, infection, granulomatous response, suboptimal esthetic outcomes (e.g. implant visibility through the eyelid), and nocturnal lagophthalmos. Implants can also induce astigmatism [18]. Implantation procedures performed with implants of insufficient weight or incorrect weight positioning can lead to postoperative lagophthalmos. In both reported cases, neither the patient’s history nor the available medical records provided information regarding the weight of the plates, the method of their production, or the surgical technique.
Several implant placement techniques are available, including pretarsal implantation above the edge of the eyelid (low pretarsal), septal, pretarsal implantation beneath the upper edge of the tarsus (high pretarsal), and orbital implantation. Higher-level implantation requires heavier implants, and this factor should be considered in preoperative planning. Implants placed higher generally yield more favorable aesthetic outcomes compared to implantation above the eyelash line. However, they are associated with a greater incidence of nocturnal lagophthalmos. The implants weigh down the eyelid by gravity when the patient is in a horizontal position. If the implant is positioned higher, there is an increased risk of lagophthalmos. The risk can be mitigated by propping the head higher on the pillow [19].
Patients reported on in the present study experienced delayed migration of the gold weight implant. In patients with persistent facial palsy, the periorbital tissues can undergo atrophy due to denervation. This may result in implant migration or extrusion. Usually, the implant penetrates through the skin, but case reports in the literature have documented implant extrusion through the tarsus, which carries the risk of corneal damage [20]. To minimize the risk of implant extrusion, technical modifications can be implemented, including [21, 22] covering of the implant with a graft of fascia lata (deep fascia of the thigh) [23], fixation of the weight to the upper edge of the tarsus, and implant placement in the reproseptal pocket. These approaches tend to induce less astigmatism and reduce the visibility of the implant, as it is concealed by more layers of tissue. In technical terms, these procedures are more challenging compared to pretarsal implantation [24]. Factors contributing to minimizing the risk of extrusion include selection of implants of appropriate weight, precise execution of the surgical procedure, central positioning, use of non-absorbable sutures, and double-layer tissue closure. Some authors report that, over time, the implant becomes enveloped by a layer of connective tissue (pseudocapsule), which stabilizes the weight [25]. In the first patient described in this study, no fibrosis was observed around the implant, whereas in the second patient, the implant migrated despite the presence of a pseudocapsule identified during the surgery. Clearly, more research is needed to investigate the impact of inflammation and fibrotic processes on implant mobility.
To date, there have been no large randomized studies comparing the incidence of implant migration following implantation of different types of weights. A study involving 44 patients showed a higher rate of extrusion for chain weights compared to plate weights [26]. Bladen et al., in a study of 107 eyelids during a five-year follow-up, reported extrusion of gold weight implants in 10% of cases. However, We Fong Siah et al., in their 10-year follow-up study of 154 eyelids, observed gold weight implant migration in 31.8% and extrusion in 4.7% of cases, and platinum weight implant migration in 3.6% of cases [13]. Extrusion rates reported in the literature range from 0 to 43% [27]. However, the duration of follow-up is important. At present, the majority of authors favor the use of platinum weight implants because of the lower incidence of complications and improved esthetic outcomes.
In both cases reported here, a decision was made to remove the implant without subsequent reimplantation. In the former case, a repeated procedure will be considered once the patient’s general condition stabilizes, whereas in the latter case, following successful anastomosis of the hypoglossal and facial nerves, the patient achieved full eyelid closure. The reimplantation rate is estimated at 13-20% [28-30]. In cases where reimplantation is considered to address weight extrusion or migration, it may be advisable to explore the option of platinum implant placement together with the application of modified surgical techniques. High-level implantation and coverage with additional tissue layers is the preferred solution. If skin atrophy is observed, the anterior surface of the implant can be covered with the fascia lata. Tarsal thinning may be an indication to reinforce the posterior surface of the implant with a cartilage graft. There are also isolated reports of the use of pericardium barrier material [31] or bioengineered products [32].
In summary, the main focus in the ophthalmological care of patients with facial nerve palsy is to protect the cornea. To achieve this goal, alongside conservative treatment options, various surgical modalities are available. Eyelid implant is a good method to improve eye closure and should be considered in every case of lagophthalmos associated with the risk of corneal complications. Eyelid implant surgery is characterized by a high level of patient satisfaction, primarily because of its minimally invasive approach, reversibility, substantial improvement in eyelid closure, and a favorable aesthetic outcome. Complications arising from eyelid implantation are generally mild and reversible, making the procedure an effective treatment for paralytic lagophthalmos. Appropriate choice of implant and suitable surgical technique can reduce the risk of complications associated with eyelid implant surgery.

 POLSKI
POLSKI